药物临床依赖性研究是具有潜在滥用风险的新药上市前的重要研究内容,我国尚无专门技术要求对此类研究进行规范管理。为此,药审中心起草了《药物临床依赖性研究技术指导原则》。经征求中心内部各相关专业及部分具有药物临床依赖性研究经验的专家及企业意见,形成征求意见稿。
我们诚挚地欢迎社会各界对征求意见稿提出宝贵意见和建议,并及时反馈给我们,以便后续完善。征求意见时限为自发布之日起一个月。
您的反馈意见请发到以下邮箱:
联系方式:zhanghao@cde.org.cn
感谢您的参与和大力支持。
附件:
1.《药物临床依赖性研究技术指导原则(征求意见稿)》征求意见反馈表(略)
2.《药物临床依赖性研究技术指导原则(征求意见稿)》起草说明
国家药品监督管理局药品审评中心
2022年4月18日
附件2
药物临床依赖性研究技术指导原则
(征求意见稿)起草说明
药物临庆依赖性研究是具有潜在滥用风险的新药上市前的重要研究内容,我国尚无专门技术要求对此类研究进行规范管理。为此,化药临床一部起草了《药物临床依赖性研究技术指导原则》,并征求中心内部各相关专业及部分具有药物临床依赖性研究经验的专家及企业意见后,形成征求意见稿。现将有关情况说明如下:
一、背景和目的
药物依赖性(Dependence)是指由于药物对生理或精神的药理作用而使机体产生反复用药的需求,以使其感觉良好或避免感觉不适。评价药物依赖性依靠对药学、非临床和临床证据的综合评估,以判断药物滥用潜力。临床依赖性评估是滥用潜力安全性评价的重要内容,由于具有特殊研究
目的和评价要求,其研究过程及数据来源贯穿于临床研究全程,通过对临床研究全程产生的相关数据的综合分析,得到关于药物临床依赖性情况的证据,与药学和非临床证据一起纳入药物依赖性的综合评估。
药物非临床依赖性评估的要求已在 2022年1月发布的《药物非临床依赖性研究技术指导原则》中予以阐述。为评估在我国研发的具有滥用潜力的创新药和改良型新药的药物依赖性程度和使用风险,指导说明书撰写,决策药品上市后风险监测要求及管理标准(如列入麻醉药品目录或精神药品目录)等,特别制定本指导原则。
二、起草过程
本指导原则由化药临床一部牵头撰写,化药临床二部、中药民族药临床部、统计与临床药理学部、药理毒理学部参与修订。本项工作自2022年初制定计划并启动撰写,2月24日召开了由专家和企业共同参与的大纲讨论会议,确定了指导原则的思路与要点内容,3月初形成初稿,经征求中心内部各
相关专业及部分具有药物临床依赖性研究经验的专家及企业意见后,经化药临床一部技术委员会审核通过,形成征求意见稿。
三、主要内容与说明
(一)背景阐述了起草背景和适用范围。
(二)主要内容
分别就临床依赖性研究计划的最核心内容进行介绍研究对象明确了需要进行临庆依赖性评估的三种情形;研究时机介绍了对于滥用潜力药物何时需要开展临床依赖性评估,以及与非临床依赖性研究的衔接;研究方法具体阐述了药物临床依赖性评估的方法,包括滥用相关不良事件收集、认知和行为测试、躯体依赖性(戒断反应)评估以及人类滥用潜力研究。
(三)说明书撰写要求
明确了在药品说明书的相应章节中需写入药物依赖性评估结论及相应的研究证据,以提供该药品相关的滥用、误用、成瘾、身体和精神依赖和耐受性信息,保障药物的临床合理使用。
附件3
药物临床依赖性研究技术指导原则
(征求意见稿)
一、背景
药物依赖性(Dependence)是指由于药物对生理或精神的药理作用而使机体产生反复用药的需求,以使其感觉良好或避免感觉不适。药物依赖性评估用于判断药物依赖性程度和使用风险,指导说明书撰写,决策药品上市后风险监测要求及管理标准(如列入麻醉药品目录或精神药品目录)等。
评价药物依赖性依靠对药学、非临床和临床证据的综合评估,以判断药物滥用潜力。临床依赖性评估是滥用潜力药物安全性评价的重要内容,由于具有特殊研究目的和评价要求,其研究过程及数据来源贯穿于临床研究全程,通过对临庆研究全程产生的相关数据的综合分析,得到关于药物临庆
依赖性情况的证据,与药学和非临庆证据一起纳入药物依赖性的综合评估。
药物非临床依赖性评估的要求已在 2022 年1月发布的《药物非临床依赖性研究技术指导原则》中予以阐述,本指导原则将介绍药物临床依赖性评估的相关要求。
本指导原则主要适用于在我国研发的具有滥用潜力的创新药和改良型新药。应
用本指导原则时,应同时参考药物临床试验质量管理规范(Good Clinical Practice,GCP)、人用药品技术要求国际协调理事会(International Council for Harmonisation
of Technical Requirements for Pharmaceuticals for HumanUse,ICH)和其他境内外已发布的相关技术指导原则。本指导原则仅代表药品监管机构当前的观点和认识,不
具有强制性的法律约束力。随着科学研究的进展,本指导原则中的相关内容将不断完善与更新。
二、研究对象
滥用潜力药物是临床依赖性评估的研究对象。滥用潜力药物通常具有中枢神经系统活性(如作用于中枢神经系统靶点)且可以产生期望的精神效应。期望的精神效应通常包括欣快感、幻觉或其它感知异常、认知和情绪变化等。
目前已知的可能与滥用潜力相关中枢神经系统靶点包括(但不限于):阿片、多巴胺、5-羟色胺、大麻素、y-氨基丁酸(GABA)、N-甲基-D-天门冬氨酸(NMDA)受体,转运体(如多巴胺、5-羟色胺、GABA ),离子通道复合物(如钙、钾、氯)。
目前认为,以下三种情形需要进行临床依赖性评估:第一,现有研究证据明确显示药物(和/或人体主要代谢产物)作用于以上中枢神经系统靶点或非临床依赖性潜力评价提示有致躯体或者精神依赖潜力时。第二,现有研究证据未明确显示药物(和/或人体主要代谢产物)作用于以上中枢神经系统靶点,但无法排除药物对以上中枢袖经系统靶点有影响或非临床依赖性潜力评价提示有致躯体或者精神依赖潜力时。第三,现有研究证提显示药物(和或人体主要代谢产物作用于除以上靶点以外的新的中枢神经系统靶点(尚未获得滥用潜力评估证据的靶点),且无法排除药物具有滥用潜力时。
三、研究时机
对于滥用潜力药物,临床依赖性评估贯穿于整个临床研究过程。现阶段,药物临床依赖性评估通常包括滥用相关不良事件收集、认知和行为测试、躯体依赖性(戒断反应)评估和人类滥用潜力研究(Human Abuse Potential. HAP)。
在最初进入人体临床研究时,即应开始有意识的进行依赖性风险指标的收集与记录。在早期临床研究阶段(I期和II 期),应注意收集与滥用潜力相关的不良事件,也可以考虑设计认知与行为测试及戒断反应观察,以尽早获得人体滥用潜力风险信号。通常,在临庆用药剂量范围基本确定后,各进入非临床特异性的依赖性试验阶段(如条件性位置偏好试验、药物辨别试验、自身给药试验、戒断试验等),同时,
临床依赖性评估仍在持续进行,包括滥用潜力相关不良事件的收集及在试验中纳入滥用潜力相关测试等。在非临床特异性的依赖性试验完成后,结合非临庆依赖性评估结果及早期临庆研究中获得的滥用风险信号,综合决策开展 HAP 研究的必要性。
相同机制靶点药物的滥用潜力特征可能具有相似性,因此,当已有相同机制靶点药物上市,并且已开展了系统的临床依赖性评估,滥用潜力特征数据充分可靠时,如果试验药的非临床依赖性评估证据及常规临庆研究中收集的滥用相关不良事件数据夫提示额外新增的依赖性风险,可以考虑不再开展认知和行为测试、躯体依赖性(戒断反应)评估和 HAP研究。需考虑到由于不同化合物在作用于相同机制靶点时,在滥用潜力特征或强度方面可能存在差异,如果该机制或靶点已知明确具有高滥用风险,或非临床依赖性评估证据及常规临床研究中收集的滥用相关不良事件数据提示可能具有额外新增的依赖性风险时,试验药仍需考虑进行完整的支持滥用潜力特
征评价的临床依赖性研究。
如果相同机制靶点药物的临床依赖性评估结果充分可靠,但在试验药的常规临床研究中获得的滥用相关不良事件数据存在明显不确定性或不可靠,则应考虑开展认知和行为测试和躯体依赖性(戒断反应)评估,以及考虑开展 HAP研究的必要性。
如果药效学研究数据不能充分支持机制靶点的相似性,则需考虑进行系统的临庆依赖性评估。
四、研究方法
(一)滥用相关不良事件收集
通常,在药物临床研究中常规纳入中枢神经系统反应相关指标的观察与评估,部分指标可能提示药物具有滥用潜力。例如:失眠、镇静、幻觉、震颤、解离状态等。在各种可以用于反映滥用潜力的症状或体征中,与欣快相关的反应是提示滥用潜力的敏感指标。如果发现与已知具有滥用风险的药
物(如兴奋剂、镇静剂等)具有相似欣快表现时,需特别引起注意。
建议将可能提示药物具有滥用潜力的症状或体征详细记录在病例报告表(Case Report Form,CRF)中,同时,需要注意报告不良事件时的术语选择,注意症状或体征表现与术语选择的匹配性。根据 ICH 国际医学用语词典(MedicalDictionary for Regulatory Activities,MedDRA),滥用相关的首选术语 (Preferred Terms,PTs)常见于但不限于归类在系统器官分类(System Organ Class,SOC)的各类神经系统疾病、精袖疾病类、全身性疾病及给药部位各种反应。
应针对单项试验对可能提示药物具有滥用潜力的不良事件数据进行独立分析。在独立分析中,应结合 CRF 中记录的症状或体征的详细描述,对可能提示药物具有滥用潜力的不良事件的发生时间、持续时间、严重程度、转归情况等进行报告,同时,注意相关症状间在发生时间与持续时间上的重叠。除了对不良事件的发生率和严直程度等进行报告与比较之外,还应结合给药剂量和不同剂量下的药代动力学(PK)及药效动力学(PD)数据进行剂量-暴露-效应(滥用潜力)关系的分析。
在健康人临床试验中收集到的可能提示药物具有滥月潜力的不良事件发生率可能高于患者参与的临床试验,该情况可能与健康人参与的早期耐受性或 PK 试验中使用的剂量范围更宽有关,在暴露于高剂量药物时上述不良事件发生率可能更高,
或者,口干患者疾病状态影响了对不良事件的敏感识别。因此,除了针对单项试验进行独立分析之外,还应汇总所有临床试验中可能提示药物具有滥用潜力的不良事件数据进行分析。可能提示药物具有滥用潜力的症状或体征往往缺乏特异性,因此,应结合药物治疗背景及受试者特征对收集到的不良事件进行评估与判断,避免将药物的目标效应与提示具有滥用潜力的症状或体征相混淆。例如,抗抑郁药产生“情绪高涨”,或者镇静安眠类药物产生“嗜睡”,这些反应会被记录为可能提示药物具有滥用潜力的不良事件,但不应被单独解释为其出现提示该药物具有滥用潜力。
滥用潜力通常表现为一症状群,因此,当发现某一种可能提示药物具有滥用潜力的症状或体征的不良事件发生率高时,应避免简单的归于滥用潜力风险信号,而需结合整体不良事件发生情况(包括是否存在强相关性的依赖性症状群综合评估与
判断。
需要注意,受试者药物使用史、躯体病史、入组试验前和试验过程中的合并用药情况等可能影响对于不良事件与滥用潜力关系的判断。滥用相关不良事件收集还可以提供间接可能与滥用潜力相关的事件发生率信息,如药物使用障碍药物过量、药物转移或药物丢失等。
(二)认知和行为测试
认知和行为测试不是新药临庆研究中必须进行的研究内容。但是,对于滥用潜力药物来说,认知和行为测试可能有助于对药物滥用潜力进行评估,提供药物中枢神经系统活性相关的额外安全性信息。认知和行为测试可以在常规的药物临床研究
进行,也可以在 HAP 研究中进行。
认知测试通常评估药物对记忆、知觉、注意力、语言能力或意识等的影响。行为测试通常评估药物对运动能力的影响,如站立时的反应时间或摇摆量。建议选择标准化的公认的测试工具进行评估,如认知功能筛查[简易智能精神状态检查量表
(MMSE)或蒙特利尔认知评估量表(MoCA)]、认知功能的总体评估(ADAS-Cog),以及专门针对某个特定认知维度的评估,如记忆力评估 [霍普金斯词语学习测验修订版
(HVLT-R)]、注意力/工作记忆评估[数字广度测验(DST)]等。如果使用自制的量表工具,需提供选择合理性的依据。
(三)躯体依赖性(戒断反应)评估
停用中枢神经系统活性药物时,可能会产生药物戒断反应,提示出现了身体依赖。因此,躯体依赖性(戒断反应)评估是滥用潜力评估的重要内容。
通常,躯体依赖性(戒断反应)评估在药物临床研究中的停药期间进行,可以设计直接停药组(有别于逐渐减量停药组)进行观察,观察期通常持续至药物的至少5个半衰期,以获得在药物完全消除过程中的完整戒断反应信息。如果以上停药期间
研究中出现了明确的严重的戒断反应,则应考虑开展一项独立的以评估躯体依赖性(戒断反应)为主要研究目的的临床试验。此类试验可以纳入目标治疗人群作为受试者,或者在不违背伦理的情况下纳入健康人,使用最高治疗剂量,并采用安慰剂对照,以排除潜在影响因素,明确药物的躯体依赖性(戒断反应)性质与程度。
常见戒断反应包括头痛、焦虑、恶心、呕吐、震颤、注意力下降、烦躁、易怒、睡眠障碍等。不同药物戒断反应不同,往往与给药期间产生的效应相反。例如,阿片类药物在给药期间可能引起镇静和便秘,而停药过程中可能出现失眠和腹泻;安非他明在给药期间可能引起精神过度敏感(mental acuity),而在停药过程中可能出现认知障碍。
对于已有相同中枢神经系统靶点药物上市,且戒断反应特征已明确的药物,可以采用收集停药期间受试者生理学指标变化和戒断症状相关不良事件的方式,并将结果与相同靶点药物的戒断反应特征进行对比分析,从而获得躯体依赖性(戒断反应)评估数据。对于新机制靶点药物,建议选择标准化的公认的戒断评估量表进行研究,如阿片戒断症状评价量表(0WS)、苯二氮蕈类药物撤药症状问卷(BWSQ)以及专门针对某个特定躯体依赖特征的评估量表等。应采集PK数据,对体内药物浓度变化与戒断反应变化的关系进行描述。
躯体依赖性是滥用潜力药物的特征之一,但具有躯体依赖性并非意味着必然具有滥用潜力。一些已知会产生躯体依赖性的药物(如单胺再摄取抑制剂类抗抑郁药)具有戒断反应,提示躯体依赖性,但并未被滥用。
(四)人类滥用潜力(HumanAbusePotentialHAP研究
针对没有相同机制靶点药物上市的新靶点药物,在非临床依赖性评估中或者常规临床研究(已纳入滥用潜力指标评估)中出现与滥用潜力相关的明显信号时,需考虑开展HAP研究。在非临床依赖性评估尚未完成或者常规临床研究(已纳入滥用潜力指标评估)中未发现滥用潜力信号时,不建议直接开展 HAP 研究。通常,HAP 研究安排在 II 期临床研究阶段或 II 期临床研究阶段结束后进行。
1、实施条件
HAP 研究必须在住院环境中进行。应由具备识别与处理中枢神经系统高危风险经验的医护人员,在配备有实施紧急抢救设备与条件的医疗机构中开展。应确保受试者在试验期间及洗脱期完成前,处于研究机构的监护环境下,不得离开研究机
构。
在开展 HAP 研究之前,应已获得了安全终止试验药的干预方法,或者制定风险可控的安全终止试验药的干预方法,以确保受试者安全。
2、受试者
HAP 研究应在有药物滥用史的人群中进行,且既往滥用药物应具备与试验药相同或相似的药理学基础,以确保受试者对于可能出现的滥用体验非常熟悉,既能识别,也能耐受,不应纳入目前正处于药物滥用阶段或正在接受药物戒断治疗的人群。建议纳入年龄在 18 岁至 55 岁的成人。
3、研究设计
HAP 研究通常包括筛选期、导入期、给药期和随访期(包括洗脱期)。
筛选期:
在受试者筛选时,应详细记录药物滥用史,包括药物使用的详细情况、使用频率、使用量、最后一次使用至今的时间等。
导入期:
在导入期,采用单次给药、双盲、交叉设计,受试者接受阳性对照药(将被用于治疗期的阳性对照药)和安慰剂。采用双侧 VAS 评估(0-100 分,50 分表示“无反应”,0分和100 分分别代表对向反应的极点)进行评估。服用安慰剂后评分分值通堂在 40-60分范事。服用阳性对照药后评分分信与安慰剂组相差至少 15 分被定义为“有意义的差异反应”达到“有意义的差异反应”的受试者进入治疗期。
最好选择曾在 HAP研究中使用过的药物作为阳性对照药。
如果计划在治疗期使用一种以上的阳性对照药,则在导入期间应对受试者进行所有阳性对照药相比于安慰剂的反应差异的评估。
如果阳性对照药为阿片类药物,建议在导入期开始前,对受试者进行“纳洛酮激发试验”,以证明受试者在生理上无阿片类药物依赖。
给药期:
治疗期通常采用随机、双盲、双模拟、安慰剂和阳性药对照、多剂量组、交叉设计。
阳性对照药应选择我国已批准上市的药品,且与试验药具有相同或相似的药理学基础。如果没有相同或相似的药理学基础的对昭药可选,可以选柽与试验药具有类似的期望的精神效应的药品作为阳性对照药。基于试验药的药理学特征和 HAP 研究目的的需要,可以选择一种以上的阳性对照药。
应选择可以产生期望的精神效应(能够代表滥用潜力)的剂量作为阳性对照药剂量。如有同一阳性对照药曾用于既往其他试验药的 HAP 研究中,且被证明具有良好的对照作用,可以考虑选择采用同样剂量。如果从夫在 HAP研究中被使用过,
首先开展一项针对阳性对照药的试验,以确定其产生期望的精神效应(能够代表滥用潜力)的剂量,以确保其在HAP 研究中可以作为对照显示出相对于安慰剂的效应灵敏度。基于 HAP 研究目的中不同对照标准的需要,可以设计多于一个的阳
性对照药剂量组。
试验药剂量的选择需考虑前期 PK 研究结果和相同或相似药理学基础药物的滥用潜力情况。通常应选择至少两个试验药剂量开展 HAP 研究,并至少包括预期临床最大治疗剂量(通常为 II 期剂量探索研究确定的 III 期研究最高给药剂量),另外可以选择预期临床最大治疗剂量2倍或3倍剂量(需确定不存在无法预期或不可控制的安全性风险),或者选择其他认为有研究价值的剂量,例如,根据前期 PK研究结果提示,试验药在不同亚组人群中(如性别、种族、年龄等)的 PK 特征有差异,可以针对亚组人群选择试验药的研究剂量。
4、评估指标
HAP 研究的评估应包括主观效应量表评估、PK 数据采集、生理指标测量,以及收集与滥用相关的不良事件。
主观效应量表评估:
滥用潜力的主观效应评估是通过对目标测量内容(如幻觉)的 VAS 评分来进行。根据目标测量内容的不同,可以采用单侧 VAS 评分或双侧 VAS 评分。单侧 VAS 评分范围为 0-100 分,0 分代表“无反应”,100 分代表“反应最强”。双侧VAS 评范围为 0-100 分,50 分代表“无反应”,0 分和 100
分分别代表对向反应的极点,例如,“镇静”的双侧 VAS 评分,50 分代表“无反应”,0 分代表“极度困倦”,100分代表“非常清醒”。
通常选择“药物喜好(Drug Liking)”VAS 评分作为主要评估指标,也可以选择其他评估指标与“药物喜好(DrugLiking)”VAS 评分一起作为联合主要评估指标,例如“高潮(High )”VAS 评分。
次要评估指标可根据试验药的药理学特性来制定 VAS 评分,例如,对试验药致幻作用的主观效应评估可以选择“幻觉”VAS 评分,对试验药中枢抑制作用的主观效应评估可以选择“镇静”VAS 评分。
主观效应量表评估的时间点应结合试验药(原型和具有中枢神经活性的代谢产物)的 PK特征进行设计,Tmax(可能出现效应高峰)附近必须设计评估时间点,除此之外,应在给药后最初的几个小时内进行相对密集的评估,在给药后首日末及后续几日期间定期进行评估。
生理指标测量:
根据试验药的药理学特性,结合试验药前期临床研究中获得的安全性数据,设计生理指标测量指标,常规指标包括临庆实验室检查、生命体征、心电图等。HAP
研究中,对受试者心率、血压、瞳孔大小、呼吸节律、氧饱和度等生理指标变化的观察非常重要,因为,它们与中枢神经效应的关系更为密切,例如,阿片类药物给药后出现瞳孔缩小。
应对试验药不同剂量下生理指标的变化情况,以及变化情况与 PK 特征的相关性进行分析。
PK数据采集:
HAP 研究中对受试者进行 PK 数据采集,用于评估主观效应、生理指标、滥用相关不良事件与试验药品体内代谢特征的相关性。
收集与滥用相关的不良事件: 在 HAP 研究中,除了常规收集试验中报告的不良事件之外,应针对试验药前期临床研究中收集到的可能提示药物具有滥用潜力的不良事件给予重点监测。
在不良事件收集时,可能出现与主观效应的重叠,例如,患者报告“幻觉”,记录入不良事件,同时也进行了“幻觉”VAS 评分。在研究过程中二者独立收集互不干扰,待数据分析时,再进行全面评估。但是,需要注意某些不良事件的发生可能影响主观效应的评估,例如,由于受试者出现了嗜睡而延误了数据收集,或者由于受试者出现了尿频而导致日常活动增多,造成受试者出现兴奋的假象。因此,应事先考虑减少因不良事件而中断或影响主观效应评估的情况,设计适当的补充评估措施。
应对试验药不同剂量下与滥用相关的不良事件的变化情况,以及变化情况与 PK特征的相关性进行分析。
5、统计分析
5.1研究假设
从统计学角度,HAP 研究是安全性研究,其目的是为了验证以下问题:(1)与安慰剂相比,阳性对照药(已知的滥用潜力药物)有稳定的滥用相关的反应:(2)试验药的滥用相关的反应小于阳性对照药;(3)试验药的滥用相关的反应与安慰剂相似。因此,
需要建立相应的假设检验:
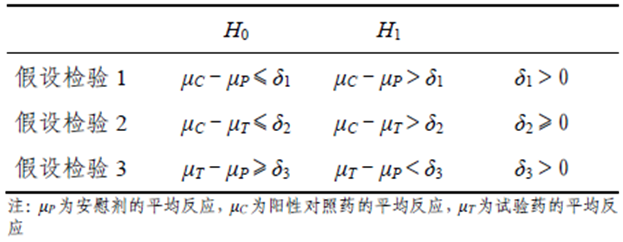
当采用的主观效应量以及药物类别和给药途径等因素不同时,5、&和8的实际值可随之变化。应在试验方案中预先设定这些界值,并说明其合理性。
所有的假设检验均应获得统计学显著性(即拒绝H,接受H)。当有多个剂量时,所有剂量的阳性对照药与安慰剂比较,所有剂量的试验药与每个剂量的阳性对照药比较,以及所有剂量的试验药与安慰剂比较,也均应获得统计学显著性。因此,不建议进行多重性调整。
5.2统计分析
所有的统计分析,包括主要分析、次要分析、替代分析和支持性分析,都应在试验方案中预先设定。
首先应对各个主观效应量、各个处理、各处理间两两比较的差异进行描述性统计,提供均值、标准误、以及其他汇总统计量,如最小值、第一个四分位数(Q1)、中位数、第三个四分位数(Q3 )、最大值等。可采用表和图呈现这些数据。
主要分析应采用线性混合效应模型,纳入周期、交叉序列和处理作为固定效应,受试者作为随机效应。对于滥用潜力的主要分析,应使用适当的检验和统计方法,在单侧显著性水平(a)为 0.05 的情况下,对试验药、阳性对照药和安慰剂产生药物
反应效应峰值(Emax)时主要测量值的均值之间的差异进行检验。
次要分析应包括次要主观效应量和客观效应量(如瞳孔大小)以及峰值效应时间。其分析应遵循与主要分析相同的程序。
对于观察到的与滥用相关的不良事件的分析,虽然没有经过统计学评价,但仍然是评估产生滥用信号的重要组成部分。
五、说明书撰写要求
应在药品说明书的相应章节中写入药物依赖性评估结论及相应的研究证据,例如【警示语】【用法用量】【不良反应】、【注意事项】【药物过量】等,提供该药品相关的消用、误用、成瘾、身体和精袖依赖和耐受性信息,保障药物的临床合理使
用。
通常,药品说明书中的药物依赖性信息来自人类研究数据,如果非临庆依赖性研究数据对评估药物依赖性有重要价值,也应写入药品说明书中。
应根据上市应用后收集到的依赖性评估数据,及时更新说明书相应章节内容。
六、小结
药物依赖性评估结论的意义在于为药品注册提供更充分的风险监测信息,以加强临床用药安全,优化药品管理,而非阻碍具有依赖性的新药上市。例如获得临床治疗剂量范围内或超剂量范围内的依赖性特征的数据和有效处理方案,作为说明书
信息指导临床合理用药,以及为药事管理提供依据(如列入麻醉药品目录或精神药品目录)以保护人群用药安全,避免滥用误用风险。
因此,药物依赖性评估应作为滥用潜力药物上市前的必要且重要的研究工作,予以重视。建议根据药物机制特征,在进入常规临床研究阶段之前即开始统筹考虑药物依赖性评估的整体安排,包括如何在常规临床研究中设计相应依赖性监测指标,
以及在剂量探索研究进展到何阶段时启动非临床特异性的依赖性试验等。对于滥用潜力可能较高的药物,鼓励在 IND 沟通中对药物依赖性评估的初步计划进行讨论。
对于滥用潜力可能较低的药物,至少在进入 III 期确证性临床研究前进行药物依赖性评估计划的沟通讨论。在滥用潜力新药递交上市申请时,需提供药物依赖性的综合评估资料与结论。
七、名词解释
药物依赖性(Dependence):是指由于药物对生理或精神的药理作用而使机体产生反复用药的需求,以使其感觉良好或避免感觉不适。
药物滥用(Drug abuse):是指对药物有意的、非医疗目的的使用,以达到期望的生理或精神效应。
药物滥用潜力(Abuse potential):是指某一特定药物具有中枢神经系统活性时发生滥用的可能性。
精神依赖(Psychological dependence):又称心理依赖性(Psychic dependence),是指基于药物的奖赏特性(产生增加药物使用可能性的正性感觉的能力)或在没有药物时产生的精神痛苦,机体对药物使用的控制力下降的一种状态。
躯体依赖(Physical dependence):是指反复用药后机体产生生理适应的一种状态,表现为突然停药或剂量明显减少后产生戒断症状。
耐受性(Tolerance):是指反复使用某种药物后机体产生生理适应的一种状态,表现为机体对药物的敏感性降低,需增大剂量才能产生原有的效应。