摘要
肺癌是中国发病率和死亡率最高的恶性肿瘤,咳嗽是肺癌患者最常见的症状,严重影响患者的治疗依从性和生活质量。国际上肺癌相关性咳嗽管理指南和共识数量少且更新慢;我国尚无肺癌相关性咳嗽管理方面的指南共识。中国抗癌协会癌症康复与姑息治疗专业委员会肺癌相关性咳嗽管理专家组整合现有的国际肺癌相关性咳嗽诊疗指南和临床研究,结合我国肺癌相关性咳嗽诊疗经验,制定了本共识,针对肺癌相关性咳嗽的评估、诊疗流程和合理用药等给出了详细的建议,旨在为肺癌相关性咳嗽的规范化治疗与管理提供指导性建议。
我国肺癌的发病率和死亡率均呈现逐年上升的趋势,是全球范围内肺癌疾病负担最重的国家[1, 2]。咳嗽是肺癌患者最常见的自诉症状,严重影响患者生活质量,临床实践中应定期评估咳嗽的严重程度[3]。然而目前国际上肺癌相关性咳嗽管理指南和共识数量少且更新慢;我国尚无相关指南共识。由于临床上评估、诊断与治疗缺乏专业指导,广大医务工作者的治疗方案往往基于临床经验,不同医疗机构诊疗差异极大,亟待规范化,通过症状管理改善患者生活质量是肿瘤支持治疗重要的临床实践目标[4, 5, 6]。本共识旨在为肺癌相关性咳嗽的规范化治疗与管理提供指导性建议,提升我国肺癌相关性咳嗽患者的生活质量和肿瘤支持治疗的整体水平。
一、相关方法学介绍
1.目标患者:肺癌相关性咳嗽患者。
2.目标医务工作者:任何等级医院的肿瘤科医师、呼吸科医师、内科医师、中医科医师、全科医师、姑息治疗/安宁疗护医师、胸外科医师等相关科室人员。
3.专家组成员:由肿瘤科专家、呼吸科专家、姑息治疗专家等组成。
4.文献检索用数据库:英文:Pubmed/Medline,Embase和Cochrane Library;中文:中国生物医学文献数据库、万方数据库、中国知网和中文科技期刊全文数据库。检索时间截至2021年5月1日。
5.证据质量和推荐强调:共识采用GRADE系统,将证据质量分为高、中、低、极低,即A、B、C、D共4级[4],证据质量定义见表1。采用GRADE推荐分级,代表的是共识小组对于某项干预措施获得的正面获益和负面风险之间的评估[5],推荐分级定义见表2。

二、肺癌相关性咳嗽的流行病学及发生机制
1.定义和分类:肺癌是慢性咳嗽的常见原因之一[6, 7, 8, 9, 10, 11]。临床常将慢性咳嗽分为两类:一类为影像学检查有明确病变者,如肺癌相关性咳嗽,另一类为影像学检查无明显异常,以咳嗽为主要或唯一症状,即传统概念的慢性咳嗽;肺癌相关性咳嗽的管理应与传统概念的慢性咳嗽的管理不同。
肺癌相关性咳嗽的定义为肺癌患者因肿瘤、肿瘤并发症及肿瘤治疗引起的咳嗽。
中华医学会呼吸病学分会(CTS)[6]、美国胸科医师学会(ACCP)[7]、德国呼吸学会(GRS)[8]制订的指南中,按时间将咳嗽分为三类:咳嗽时间9]。肺癌相关性咳嗽分类的时间界定与其他病因导致的咳嗽不同。《慢性咳嗽(第2版)》中[11],在胸部影像学检查结果稳定、排除其他原因情况下,将肺癌患者术后下床活动后出现不超过2周的咳嗽,定义为术后亚急性咳嗽;超过2周的干咳定义为肺癌术后顽固性咳嗽。肺癌相关性咳嗽的治疗方案选择,通常不受咳嗽症状持续时间的影响,但患者是否有痰与镇咳药物的选择相关。
2. 发生率和特点:我国肺癌的发病率和死亡率均位居恶性肿瘤首位[12, 13]。中国肺癌发病率和死亡率分别占全球的37.0%和39.8%[2]。50%以上的肺癌患者在诊断时有咳嗽症状[14, 15]。咳嗽常为中央型肺癌的早期症状,周围型肺癌患者早期咳嗽较少。肺癌手术后约25%的患者出现慢性干咳[16]。美国和欧洲接受化疗的晚期非小细胞肺癌患者中,90%以上的患者出现咳嗽,且64.8%的患者存在慢性咳嗽[17, 18]。62%的肺癌患者认为咳嗽严重到需要治疗的程度[19]。对我国2 424名医护人员的“肺癌患者咳嗽管理现状及医护人员观念和实践调研”的结果显示[20],肺癌相关性咳嗽发生率为 51%~75%,咳嗽是肺癌患者最常见的症状,其余肺癌相关性咳嗽调研数据见表3。

除了合并其他原因引起的咳嗽之外,肺癌相关性咳嗽以刺激性干咳为主要特征[21]。胸外科术后慢性咳嗽也多以干咳为主[11]。36.2%的肺癌相关性咳嗽患者在癌症诊断后才开始出现咳嗽症状;而确诊肺癌前出现咳嗽症状的患者,其咳嗽症状存在的中位时间为12.4周,但个体间差异大。多数患者为中至重度咳嗽,肺癌患者咳嗽的视觉模拟评分(VAS)为32(20~51)分[19]、40(20~69)分[22]。肺癌患者咳嗽往往迁延不愈,中位持续时间为52(9~260)周[19],而25%的患者在肺癌术后咳嗽持续时间超过5年[11]。
3.发生机制:咳嗽可能是由过度刺激、过敏或神经元通路受损引起的,损伤可能发生在气道和中枢神经系统内[23]。肺癌相关性咳嗽的机制主要包括4个方面[11]:(1)直接刺激:生长于气道的肿瘤牵拉、收缩气道,刺激机械敏感性咳嗽感受器,通过有髓鞘Aδ纤维,经迷走神经传导,形成咳嗽反射;局部炎症刺激化学敏感性咳嗽感受器,如无髓鞘C纤维,通过反射通路引起咳嗽。由于咳嗽感受器分布在气道上,与周围型肺癌相比,中央型肺癌更容易出现咳嗽。(2)继发性阻塞性肺炎:由于气道阻塞,分泌物引流不畅继发各种病原体感染,可伴发热、胸痛和呼吸困难。(3)神经源性炎症:肺神经内分泌肿瘤都有表达神经肽类物质的能力,肿瘤细胞释放神经肽作用于C纤维,可引起气道神经源性炎症。(4)抗肿瘤治疗相关不良反应:肺癌患者手术后,残端炎症反应,手术过程损伤肺C纤维;化疗或放疗后气道黏膜损伤,使气道反应性增高。这些因素可能同时存在,共同作用加剧咳嗽。
4.并发症和危害:反复剧烈咳嗽可以引起呼吸、循环、消化、泌尿生殖、骨骼和神经等系统的各种并发症,咳嗽并发症发生率可达20%~30%[11]。咳嗽对肺癌患者的生理、心理及社会生活等方面均会造成影响,可加剧疼痛、疲劳、失眠、呼吸困难等症状。接受支持治疗的肺癌患者中,咳嗽是发生率最高且对患者生活质量影响最严重的两种症状之一[24]。15%的肺癌相关性咳嗽患者自诉因咳嗽导致明显睡眠障碍[22]。咳嗽引发的压力性尿失禁显著影响女性患者的生活质量,应在患者就诊时询问并积极治疗[8]。肺癌术后切口周围疼痛及咳嗽是最常见的两大并发症,咳嗽会加剧疼痛,直接影响伤口愈合。咳嗽引发的肋骨骨折是慢性咳嗽患者潜在的严重并发症,肿瘤患者咳嗽还可能导致骨转移性疼痛的加剧[25]。肿瘤患者的长期慢性咳嗽影响患者睡眠,加重患者焦虑情绪,影响治疗依从性。改善肺癌患者咳嗽等呼吸道症状,对提高患者及家属/照护者的生活质量同样具有重要的意义[26]。
三、肺癌相关性咳嗽的评估
可采用症状强度和生活质量两种类型的量表进行评估,咳嗽症状积分、VAS、数字分级法(NRS)是常用的咳嗽症状强度评估方法。
1. 咳嗽症状积分:用于咳嗽程度和疗效的临床评定。目前有研究正在开发新的咳嗽症状积分评估量表[11],分为日间积分和夜间积分,但是不同级别之间不容易区分,具体见表4(2B)。

2.VAS:由患者根据自己的感受在标记0~10 cm的直线上划记相应刻度以表示咳嗽的程度,也可以采用0~100 mm标记。与咳嗽症状积分相比,VAS的评分等级划分更细,有助于肺癌相关性咳嗽治疗前后的纵向比较(1A)。
3.NRS:已有研究对肺癌术后患者采用NRS评估咳嗽[27]。因肺癌相关性咳嗽患者往往同时存在如疼痛等需要支持治疗的其他症状,故评分量表中NRS更易被广泛使用,具体见表5(1A)。

4.咳嗽生活质量测评:针对咳嗽的专用量表主要为慢性咳嗽影响问卷(CCIQ),包括咳嗽专用生活质量问卷(CQLQ)、莱切斯特咳嗽问卷(LCQ),两者均表现出良好的信度、效度及反应度。其中,中文版莱切斯特咳嗽问卷(LCQ-MC)应用广泛,被证实有很好的可靠性、可重复性和灵敏度[28]。LCQ-MC具有简明、便于使用的特点,常用于肺癌相关性咳嗽患者的评估[29]。LCQ-MC包括3个维度,即生理维度、心理维度和社会维度,共19个条目。各条目采用Likert 7级评分法,总分为各维度平均分之和,为3~21分。问卷得分越高,说明受咳嗽影响越小,生活质量越高。本共识推荐采用LCQ-MC对肺癌相关性咳嗽相关生活质量进行评估(1A)。
5.频率监测:对患者一定时间内咳嗽频率、强度和特征进行客观记录和分析。目前临床中对咳嗽频率监测均未广泛应用,本共识暂不推荐。
【推荐意见】推荐选择VAS、NRS评分方法中的一种进行咳嗽强度评估。中文版LCQ-MC可从多维度进行评估,具有简明、便于使用的特点,推荐用于咳嗽生活质量的测评。
四、肺癌相关性咳嗽的诊断与鉴别诊断
1.诊断:应评估包含肿瘤原因在内的全部可能引起肺癌患者咳嗽的原因[30]。肿瘤因素和非肿瘤因素均可能是肺癌患者咳嗽的独立病因,二者也可能同时存在,因此,多学科诊疗(MDT)理念尤为重要。尤其在肺癌相关性咳嗽的诊断和鉴别诊断阶段,可采取MDT团队会诊的方式,尽快明确患者咳嗽病因,从而制定明确对症的后续管理方案(1A)。
肺癌患者既往无呼吸系统疾病病史,除干咳外无其他症状,实验室检查和影像学检查除外其他原因引起的咳嗽,应考虑诊断为肺癌相关性咳嗽。肺癌患者术后出现的咳嗽,胸部CT检查除外其他疾病,没有哮喘、鼻后滴漏综合征等证据,可使用甲磺司特进行治疗性诊断。肺癌患者针对肿瘤进行放化疗后出现的咳嗽,没有合并其他引起咳嗽的证据时,可使用皮质类固醇进行治疗性诊断。经抗癌治疗和(或)镇咳治疗后,肺癌患者咳嗽完全缓解,说明肺癌相关性咳嗽诊断明确且治疗方案正确;如未完全缓解,应重新评估影响疗效的原因及可能合并的其他病因,进行鉴别诊断[5](1A)。
2.鉴别诊断:肺癌患者出现急性咳嗽,需首先排除一些重症疾病,如急性心肌梗死、左心功能不全、肺炎、气胸、肺栓塞及异物吸入。
除外肿瘤因素,肺癌患者最常见的咳嗽原因是合并慢性阻塞性肺疾病(COPD)、慢性支气管炎等呼吸系统疾病,或者合并感染[20]。患者干咳主要见于非感染性咳嗽,痰量较多、咳脓性痰者应考虑合并呼吸道感染性疾病,血常规和胸部CT检查通常可以进行鉴别。哮喘、慢性支气管炎、COPD等原有疾病加重或急性发作,也可能是肺癌患者出现咳嗽的原因,通过详细询问患者病史可初步鉴别,肺功能检查、实验室检查和影像学检查可以进一步明确诊断。
肺癌患者服用血管紧张素转化酶抑制剂(ACEI)类药物后出现的咳嗽,考虑药物引起,更换药物可以鉴别;血清学抗体检测有助于鉴别支原体感染引起的咳嗽;普通感冒引起的咳嗽,患者常有鼻部相关症状;支气管激发试验有助于鉴别咳嗽变异性哮喘;诱导痰嗜酸粒细胞学检查有助于嗜酸粒细胞性支气管炎的诊断;考虑合并胃食道反流性咳嗽时,24 h食管pH值监测有助于鉴别;上气道咳嗽综合征/鼻后滴漏综合征患者多数合并鼻咽部症状,鼻窦部CT有助于鉴别。肺癌相关性咳嗽患者合并其他病因引起的咳嗽,通过详细询问病史,结合实验室和影像学检查通常可以进行鉴别,具体参见《咳嗽的诊断与治疗指南(2015)》[6],必要时可以请相关科室医师会诊(1A)。肺癌相关性咳嗽诊断流程详见图1。
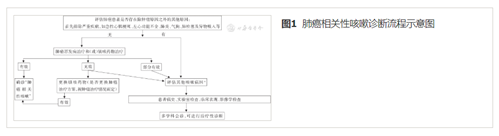
【推荐意见】肺癌相关性咳嗽的诊断可采用MDT团队会诊方式,综合参考肿瘤科、呼吸科、影像科等各相关科室医师意见,尽快明确肺癌患者咳嗽原因,从而制定合理的治疗方案。
五、肺癌相关性咳嗽的治疗
肺癌相关性咳嗽的治疗主要是病因治疗和镇咳药物治疗。肺癌相关性咳嗽的治疗流程见图2。
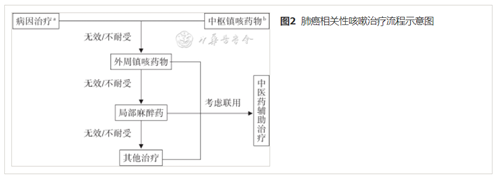
(一)病因治疗
应先明确患者咳嗽的病因,进行针对性治疗(1A)。针对肿瘤的治疗是缓解肺癌相关性咳嗽的最佳方案[11]。肺癌的治疗应当采取MDT与个体化治疗相结合的原则。根据患者的机体状况、肿瘤的病理组织学类型和分子分型、侵及范围和发展趋势采取多学科综合治疗的模式,有计划、合理地应用手术、放疗、化疗、分子靶向治疗、免疫治疗、微创介入治疗等手段,以期达到最大限度地延长患者的生存时间、提高生存率、控制肿瘤的进展和改善患者的生活质量的目标。肺癌相关性咳嗽患者的肿瘤原发病治疗,具体参见中国临床肿瘤学会(Chinese Society of Clinical Oncology,CSCO)《非小细胞肺癌诊疗指南(2020)》[14]和《小细胞肺癌诊疗指南(2021)》[15]。如肺癌患者既往存在引起咳嗽的呼吸系统疾病,或合并其他如感染、过敏等引起咳嗽的原因,应同时针对上述病因进行治疗,参见《咳嗽的诊断与治疗指南(2015)》[6]。
【推荐意见】肺癌相关性咳嗽的治疗首先应根据患者病因进行针对性治疗。个体化治疗患者肿瘤是缓解肺癌相关性咳嗽的最佳方案。病因治疗应贯穿肺癌相关性咳嗽治疗的全程,并根据患者不同时期的咳嗽病因及时调整治疗方案。
(二)镇咳药物治疗
药物治疗是肺癌相关性咳嗽主要治疗方式。咳嗽可能存在中枢敏化的过程[31],应及早给予有效的镇咳治疗,尽早控制咳嗽症状。可在病因治疗过程中,同时给予镇咳药物。中枢镇咳药物和外周镇咳药物是最主要的镇咳药物。作用于咳嗽反射活动中枢环节的药物称为中枢镇咳药,如可待因、福尔可定等;抑制其他环节的称为外周镇咳药物,如那可丁等[32]。在镇咳治疗的过程中,如果某类药物无法缓解,应及时更换治疗方案或考虑多模式镇咳方式达到疗效较好、且不良反应较低的目标(1A)。常用中枢和外周镇咳药物的用法推荐见表6。

1. 中枢镇咳药物:中枢镇咳药物是治疗肺癌相关性咳嗽的最有效药物[11],阿片类药物是最具代表性的中枢镇咳药物[33]。系统评价和meta分析显示在各种治疗方式中,阿片类药物可以有效缓解肺癌相关性咳嗽[34, 35]。临床常用的中枢镇咳药物包括可待因、右美沙芬、吗啡、福尔可定等。
(1)可待因:可待因(甲基吗啡)是吗啡前体药物,可被肝脏中的细胞色素P450 2D6(CYP2D6)激活,在体内去甲基化后转化为吗啡,发挥作用[36]。可待因可以选择性抑制咳嗽延髓中枢,镇咳作用强而迅速。美国胸科医师学会(CHEST)制定的《成人肺癌相关性咳嗽处理:胸部指南和专家小组报告》中指出,尽管关于可待因的镇咳研究在肺癌相关性咳嗽领域中最多,但由于可待因比其他阿片类药物有更多的不良反应,所以在肺癌相关性咳嗽治疗中,对可待因并不进行优先推荐[33]。可待因的疗效和安全性依赖于CYP2D6 的活性和遗传多态性,个体差异使可待因的生物学效应具有不可预测性[37]。部分患者因CYP2D6基因多态性差异导致可待因“超快代谢”,这种代谢差异将导致使用可待因后出现严重不良反应,临床中往往很难鉴别患者CYP2D6的基因多态性差异。同时应注意的是,多痰的咳嗽患者禁用可待因,以防止因抑制咳嗽反射而使痰液阻塞呼吸道,或继发感染而加重病情[38](2B)。
(2)右美沙芬:右美沙芬在结构上与吗啡具有相关性,但并不与μ受体结合,其镇咳机制尚不明确,可能与N-甲基-D-天冬氨酸(NMDA)受体和sigma-1受体相关[39]。右美沙芬镇咳作用与可待因相似,但没有镇静和镇痛作用。临床中右美沙芬治疗肺癌相关性咳嗽的临床研究极少,在包括癌症患者在内的两个随机对照试验中,右美沙芬对咳嗽的改善程度优于安慰剂[26]。右美沙芬在咳嗽治疗中用药时间往往较短,其药物依赖性被低估。近年来,滥用右美沙芬导致的药物依赖性逐渐引发关注[40],提示在肺癌相关性咳嗽治疗中也应考虑右美沙芬的药物依赖风险(2B)。
(3)吗啡:吗啡通过直接作用于中枢神经系统和含平滑肌的器官使动静脉血管舒张,周围血管阻力下降,作用于咳嗽中枢,产生镇咳作用。吗啡的镇咳疗效与镇痛疗效不同,不存在剂量依赖性的升高[41]。如果咳嗽不被其他阿片类药物衍生物或其他手段所抑制,则应使用吗啡。考虑到其不良反应发生率较高,并具有成瘾性,尤其是便秘发生率较高,因此起始剂量通常为5 mg。对于已使用吗啡治疗癌痛的患者,可以将其剂量提高20%,观察疗效并关注不良反应情况[33](2B)。
(4)福尔可定:福尔可定在可待因的结构基础上添加了吗啉基团,使其不能在体内转化为吗啡,因此依赖性极小[36,42]。10 mg福尔可定镇咳作用比15 mg可待因疗效更优且更持久[43]。福尔可定可用于新生儿和儿童,呼吸抑制作用弱,不易引起便秘[11]。对于肺癌患者而言,镇咳治疗时间较长,应兼顾镇咳疗效和呼吸抑制、便秘等不良反应的管理。因疗效和安全性的优势,福尔可定或可作为肺癌镇咳的首选药物[20](1A)。
其他可用于肺癌相关性咳嗽治疗的中枢镇咳药物还包括氢可酮、双氢可待因等[44]。吗啡和可待因等吗啡类药物有呼吸抑制和成瘾性等风险,因此,在肺癌相关性咳嗽的治疗中限制了其长期应用的可能性[11]。需要注意的是,对于存在疼痛的肺癌相关性咳嗽患者,如果患者已接受吗啡类药物镇痛治疗,那么在镇咳过程中应注意使用剂量,密切关注和管理不良反应。阿片类药物治疗通常会出现不同程度的不良反应,这些不良反应通过预防和合理管理往往可以较好地进行控制。
【推荐意见】中枢镇咳药物是治疗肺癌相关性咳嗽的最有效药物。推荐使用福尔可定作为肺癌镇咳的首选药物。可待因由于其不良反应,不进行优先推荐。使用右美沙芬时应注意其长期使用的安全性。吗啡镇咳疗效不存在剂量依赖性升高,且存在较多不良反应,因此,不做优先推荐,对于已使用吗啡治疗癌痛的患者,可考虑将其剂量提高20%,观察疗效并关注不良反应。
2.外周镇咳药物:外周镇咳药物作用于咳嗽反射弧的传入神经、传出神经或感受器中1个或多个位点。常用药物包括那可丁、左羟丙哌嗪、苯丙哌林等。CHEST《成人肺癌相关性咳嗽处理:胸部指南和专家小组报告》指出,若持续性使用阿片类药物产生耐药性或由于诸多原因未首选阿片类药物治疗时,建议使用外周性镇咳药[33]。基于外周镇咳药的潜在获益,可在阿片类药物镇咳无效或患者不耐受的情况下选择使用。
(1)那可丁:那可丁属于苄异喹啉类生物碱,最早发现于罂粟乳液提取物中。那可丁对呼吸中枢无抑制作用,其镇咳机制与抑制ACEI有关,ACEI抑制缓激肽降解,而缓激肽积累是干咳的病因之一[45];也可以抑制肺牵张反射引起的咳嗽[32]。目前几乎没有那可丁用于肺癌相关性咳嗽的临床研究,但有一定量的研究探讨其潜在的抗肿瘤作用[46, 47],因此,可作为中枢镇咳药物无效或患者不耐受时的一种选择(2B)。
(2)左羟丙哌嗪:左羟丙哌嗪是苯丙哌嗪的衍生物,是羟丙哌嗪的左旋异构体,其镇咳机制可能是抑制C纤维的活化[48]。Meta分析显示,左羟丙哌嗪缓解咳嗽的作用可能与双氢可待因相似,但由于纳入的4项研究均有严重的局限性和高偏倚风险,尚需要进一步研究证实[34](2B)。
(3)苯丙哌林:苯丙哌林可以阻断肺、胸膜的牵张感受器产生的肺迷走神经反射,也可以直接对咳嗽中枢产生抑制[32]。有研究探讨苯丙哌林的肿瘤抑制作用[49],但尚无研究探讨其具体镇咳机制[50],尚不明确其治疗肺癌相关性咳嗽的具体疗效,仅作为中枢镇咳药物无效或患者不耐受时的尝试性用药(2B)。
【推荐意见】外周镇咳药物没有确切的肺癌相关性咳嗽的临床证据。但基于其可能存在的潜在获益,对于存在中枢镇咳药物禁忌证,或中枢镇咳药物无效或不耐受时,可作为肺癌相关性咳嗽治疗的一种选择。
3.复方镇咳药物:除镇咳药物之外,祛痰剂、减充血剂、抗组胺药物也是复方镇咳药物的常见成分。复方镇咳药物含有的镇咳药物成分,以中枢镇咳药物如福尔可定、右美沙芬为主;也有含有外周镇咳药物如那可丁的复方镇咳药。愈创木酚甘油醚是复方镇咳药物最常含有的祛痰剂。对于排除其他病因的有痰患者,使用含有祛痰剂的中枢镇咳复方糖浆往往有效,可以扩张支气管,降低气道分泌物黏度,起到化痰作用,利于镇咳(2B)。
复方镇咳药物以糖浆类药物为主,各类复方糖浆中的镇咳药物浓度存在差异,患者往往难以严格控制药物剂量,存在用量不足或过量的风险。另外,含中枢镇咳药物的复方糖浆中往往含有抗组胺药物,抗组胺药物常见镇静、疲劳、困倦、嗜睡等不良反应[51],其长期应用的相关研究缺乏、安全性未知。肺癌相关性咳嗽患者镇咳药物使用时间往往比其他慢性咳嗽患者长,对于长期使用含抗组胺类药物复方糖浆的安全性应保持谨慎态度(2C)。
【推荐意见】排除其他病因情况下,有痰的肺癌相关性咳嗽患者可考虑含有中枢镇咳药物和祛痰剂的复方镇咳药物。复方镇咳药物的长期安全性不明确,特别是含有抗组胺药物的复方镇咳药物,应尽量避免长期使用。
4.局部麻醉药:在阿片类药物镇咳无效或不耐受,且外周镇咳药物无效的情况下,可尝试使用局部麻醉药进行镇咳。雾化吸入局部麻醉药可快速作用于咳嗽中枢,减少或阻断咳嗽中枢引发的咳嗽与喘息,起到镇咳作用。代表药物包括雾化利多卡因、雾化布比卡因等[33]。尽管有一些临床研究显示了局部麻醉药的镇咳作用[44],但需要注意的是,局部麻醉药存在误吸风险。体弱的癌症患者本身具有误吸风险,在使用局部麻醉药之前应当仔细评估其风险[52],并在使用后至少1 h内禁食禁水以避免误吸[53]。局部麻醉药在肺癌镇咳中的使用应结合患者个体情况和医疗机构自身资源情况,在保障患者安全情况下合理使用(2C)。
【推荐意见】局部麻醉药没有治疗肺癌相关性咳嗽的临床证据,因此,仅在中枢和外周镇咳药物均无效的情况下进行尝试性使用,使用前应当仔细评估患者误吸风险。
5.其他治疗:建议将皮质类固醇用于治疗肺癌患者化疗或放射性肺炎引起的咳嗽(1B)。大环内酯类药物作为免疫调节剂,可用于类固醇药物治疗的辅助治疗或类固醇保护剂[30](2B)。
肺癌患者的气管插管、支气管镜手术等治疗常引起呼吸道黏膜损伤、出血、气道水肿,可导致患者出现咳嗽、咳痰、支气管痉挛等各种并发症[54]。祛痰药物与吸入糖皮质激素、支气管舒张剂的联合使用对于改善患者呼吸道症状有重要作用,可选择性用于肺癌围手术期咳嗽患者的症状控制。对于中枢和外周镇咳药物无效的肺癌相关性咳嗽患者,可根据临床经验采用上述药物,或两种甚至两种以上药物混合后雾化使用,使用前应评估不同药物联合雾化的配伍相容性,以及对雾化装置最大容量和雾化时间的要求。常规雾化吸入对于肺癌相关性咳嗽症状缓解的作用尚需要临床试验进一步证实(2C)。甲磺司特可缓解肺癌术后的咳嗽[11](2B)。
白三烯受体拮抗药,如孟鲁司特钠,对缓解气道炎症、过敏反应等方面具有一定的作用[32],可能对肺癌相关性咳嗽合并气道高敏感性的患者具有疗效(2C)。
【推荐意见】对于特定患者可考虑使用对应的特定药物进行肺癌相关性咳嗽的治疗。对于中枢和外周镇咳药物均无效的患者,可在充分评估获益和风险后,尝试性依据临床经验选择镇咳药物。
6.中医药治疗:适宜的中药外用贴剂、口服制剂、中药汤剂以及中药注射剂等可能有一定作用。中医理论中,根据正邪交争主导的不同,肺癌相关性咳嗽分为发作期和缓解期,治疗方案存在差异[55]。可以请中医科医师会诊,共同制定诊疗方案。考虑到中医药相关研究的质量和可能存在的安慰剂效应,在阿片类药物治疗无效或患者不耐受时,可考虑根据患者情况、医院情况和经验,必要时使用合适的中药、中药组方、成药或穴位敷贴等作为辅助治疗或多模式治疗的一部分(2B)。
【推荐意见】对于阿片类药物治疗无效或不耐受的肺癌相关性咳嗽患者,可与中医科共同进行MDT会诊,根据中医理论结合医院临床经验,选择适宜的中药、中药组方、成药或穴位敷贴等方案进行辅助治疗或作为多模式治疗的一部分。
对症支持治疗已成为肿瘤治疗最重要的组成部分之一,近年来肺癌在中国和全世界的发生率均持续增高[56],肺癌症状全程化管理的意义重大。咳嗽是肺癌最常见的症状,严重影响患者生活质量。我国对咳嗽的症状管理水平远远滞后于其他肿瘤相关症状,不同医疗机构诊疗差异极大,亟待规范化。本共识为国内肺癌相关性咳嗽管理相关领域同仁提供理论和实践参考,以期进一步提高我国肺癌相关性咳嗽诊疗水平。
共识制定专家组组长:王杰军(上海长征医院肿瘤科);罗素霞(河南省肿瘤医院肿瘤内科)
共识制定专家组副组长:张力(中山大学肿瘤防治中心 中山大学附属肿瘤医院肿瘤内科);赖国祥(解放军联勤保障部队第九〇〇医院呼吸与危重症医学科);黄诚(福建省肿瘤医院肿瘤内科);刘辉国(华中科技大学同济医学院附属同济医院呼吸与危重症医学科)
共识制定专家组成员(按姓氏汉语拼音排序):陈娜(河南大学淮河医院呼吸科);陈元(华中科技大学附属同济医院胸部肿瘤科);褚倩(华中科技大学同济医学院附属同济医院胸部肿瘤科);贾金广(郑州人民医院呼吸科);姜淑娟(山东第一医科大学附属省立医院呼吸与危重症医学科);焦晓栋(上海长征医院肿瘤科);刘波(山东省肿瘤医院肿瘤内科);刘勇(徐州市中心医院肿瘤内科);梅家转(郑州人民医院肿瘤内科);任光明(徐州市第一人民医院呼吸科);王碧芸(复旦大学附属肿瘤医院肿瘤内科);王琼(江阴市人民医院肿瘤内科);王玉梅(中国医科大学附属盛京医院宁养科);余慧青(重庆大学附属肿瘤医院缓和医疗科);张沂平(中国科学院大学附属肿瘤医院 浙江肿瘤医院胸部肿瘤内科);庄莉(云南省肿瘤医院姑息医学科)
利益冲突
所有作者均声明不存在利益冲突
参考文献
1.中华医学会肿瘤学分会, 中华医学会杂志社. 中华医学会肿瘤学分会肺癌临床诊疗指南(2021版)[J]. 中华医学杂志, 2021, 101(23):1725-1757. DOI: 10.3760/cma.j.cn112137-20210207-00377.
2.SungH, FerlayJ, SiegelRL, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3):209-249. DOI: 10.3322/caac.21660.
3.张希龙, 陈宝元. 肺癌患者的睡眠与睡眠呼吸问题[J]. 中华医学杂志, 2019, 99(6):407-410. DOI: 10.3760/cma.j.issn.0376-2491.2019.06.003.
4.BalshemH, HelfandM, SchünemannHJ, et al. GRADE guidelines: 3. Rating the quality of evidence[J]. J Clin Epidemiol, 2011, 64(4):401-406. DOI: 10.1016/j.jclinepi.2010.07.015.
5.AndrewsJ, GuyattG, OxmanAD, et al. GRADE guidelines: 14. Going from evidence to recommendations: the significance and presentation of recommendations[J]. J Clin Epidemiol, 2013, 66(7):719-725. DOI: 10.1016/j.jclinepi.2012.03.013.
6.中华医学会呼吸病学分会哮喘学组. 咳嗽的诊断与治疗指南(2015)[J]. 中华结核和呼吸杂志, 2016, 39(5):323-354. DOI: 10.3760/cma.j.issn.1001-0939.2016.05.003.
7.IrwinRS, BaumannMH, BolserDC, et al. Diagnosis and management of cough executive summary: ACCP evidence-based clinical practice guidelines[J]. Chest, 2006, 129(1Suppl):1S-23S. DOI: 10.1378/chest.129.1_suppl.1S.
8.KardosP, DinhQT, FuchsKH, et al. German Respiratory Society guidelines for diagnosis and treatment of adults suffering from acute, subacute and chronic cough[J]. Respir Med, 2020, 170:105939. DOI: 10.1016/j.rmed.2020.105939.
9.中华医学会, 中华医学会杂志社, 中华医学会全科医学分会, 等. 咳嗽基层诊疗指南(2018年)[J]. 中华全科医师杂志, 2019, 18(3):207-219. DOI: 10.3760/cma.j.issn.1671-7368.2019.03.002.
10.MoriceAH, MillqvistE, BieksieneK, et al. ERS guidelines on the diagnosis and treatment of chronic cough in adults and children[J]. Eur Respir J, 2020, 55(1):1901136. DOI: 10.1183/13993003.01136-2019.
11.赖克方, 钟南山. 慢性咳嗽[M]. 2版.北京:人民卫生出版社,2019.
12.郑荣寿, 孙可欣, 张思维, 等. 2015年中国恶性肿瘤流行情况分析[J]. 中华肿瘤杂志, 2019, 41(1):19-28. DOI: 10.3760/cma.j.issn.0253-3766.2019.01.008.
13.ChenWQ,ZhengRS,BaadePD,et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin,2016,66(2):115-132. DOI: 10.3322/caac.21338.
14.中国临床肿瘤学会指南工作委员会. 中国临床肿瘤学会(CSCO)非小细胞肺癌诊疗指南(2020)[M]. 北京:人民卫生出版社,2020.
15.中国临床肿瘤学会指南工作委员会. 中国临床肿瘤学会(CSCO)小细胞肺癌诊疗指南(2021)[M]. 北京:人民卫生出版社, 2020.
16.MiyamotoH, SakaoY, SakurabaM, et al. Usefulness of suplatast tosilate for chronic cough following lung cancer surgery[J]. Gen Thorac Cardiovasc Surg, 2009, 57(9):463-466. DOI: 10.1007/s11748-009-0426-0.
17.IyerS, RoughleyA, RiderA, et al. The symptom burden of non-small cell lung cancer in the USA: a real-world cross-sectional study[J]. Support Care Cancer, 2014, 22(1):181-187. DOI: 10.1007/s00520-013-1959-4.
18.IyerS, Taylor-StokesG, RoughleyA. Symptom burden and quality of life in advanced non-small cell lung cancer patients in France and Germany[J]. Lung Cancer, 2013, 81(2):288-293. DOI: 10.1016/j.lungcan.2013.03.008.
19.HarleA, BlackhallFH, MolassiotisA, et al. Cough in patients with lung cancer: a longitudinal observational study of characterization and clinical associations[J]. Chest, 2019, 155(1):103-113. DOI: 10.1016/j.chest.2018.10.003.
20.罗素霞, 赖国祥, 张力, 等. 中国肺癌患者咳嗽管理现状及医护人员观念和实践调研[J]. 中华医学杂志, 2021, 101(21):1583-1591. DOI: 10.3760/cma.j.cn112137-20210413-00877.
21.赵凌云, 李宏云. 慢性咳嗽的治疗新进展[J]. 中国全科医学, 2021, 24(8):930-940, 946. DOI: 10.12114/j.issn.1007-9572.2021.00.113.
22.HarleA, MolassiotisA, BuffinO, et al. A cross sectional study to determine the prevalence of cough and its impact in patients with lung cancer: a patient unmet need[J]. BMC Cancer, 2020, 20(1):9. DOI: 10.1186/s12885-019-6451-1.
23.HarleAS, BlackhallFH, SmithJA, et al. Understanding cough and its management in lung cancer[J]. Curr Opin Support Palliat Care, 2012, 6(2):153-162. DOI: 10.1097/SPC.0b013e328352b6a5.
24.刘冉冉, 邹振亚, 王仁秀, 等. 姑息治疗的肺癌患者症状群与生活质量相关性分析[J]. 护理学报, 2019, 26(6):38-42. DOI: 10.16460/j.issn1008-9969.2019.06.038.
25.HowardS. The art and science of palliative medicine[M]. Hong Kong: AME Publishing Company, 2014.
26.YamaguchiT, GoyaS, KoharaH, et al. Treatment recommendations for respiratory symptoms in cancer patients: clinical guidelines from the Japanese society for palliative medicine[J]. J Palliat Med, 2016, 19(9):925-935. DOI: 10.1089/jpm.2016.0145.
27.程钧, 曹隆想, 牛越群, 等. 普胸外科术后慢性咳嗽相关因素分析[J/CD]. 中华胸部外科电子杂志, 2017, 4(3):177-180. DOI: 10.3877/cma.j.issn.2095-8773.2017.03.09.
28.MaW, YuL, WangY, et al. Changes in health-related quality of life and clinical implications in Chinese patients with chronic cough[J]. Cough, 2009, 5:7. DOI: 10.1186/1745-9974-5-7.
29.黄群, 陈兰, 周淋琳, 等. 肺癌患者术后咳嗽相关生活质量现况及其影响因素[J]. 解放军护理杂志, 2018, 35(8):18-22. DOI: 10.3969/j.issn.1008-9993.2018.08.004.
30.SimoffMJ, LallyB, SladeMG, et al. Symptom management in patients with lung cancer: diagnosis and management of lung cancer, 3rd ed: American College of Chest Physicians evidence-based clinical practice guidelines[J]. Chest, 2013, 143(5Suppl):e455S-e497S. DOI: 10.1378/chest.12-2366.
31.GibsonPG, VertiganAE. Management of chronic refractory cough[J]. BMJ, 2015, 351:h5590. DOI: 10.1136/bmj.h5590.
32.国家药典委员会.中华人民共和国药典临床用药须知[M]. 北京:中国医药科技出版社, 2017.
33.MolassiotisA, SmithJA, MazzoneP, et al. Symptomatic treatment of cough among adult patients with lung cancer: CHEST guideline and expert panel report[J]. Chest, 2017, 151(4):861-874. DOI: 10.1016/j.chest.2016.12.028.
34.MolassiotisA, BaileyC, CaressA, et al. Interventions for cough in cancer[J]. Cochrane Database Syst Rev, 2015, 5:CD007881. DOI: 10.1002/14651858.CD007881.pub3.
35.YancyWS, McCroryDC, CoeytauxRR, et al. Efficacy and tolerability of treatments for chronic cough: a systematic review and meta-analysis[J]. Chest, 2013, 144(6):1827-1838. DOI: 10.1378/chest.13-0490.
36.JairajM, WatsonDG, GrantMH, et al. Comparative biotransformation of morphine, codeine and pholcodine in rat hepatocytes: identification of a novel metabolite of pholcodine[J]. Xenobiotica, 2002, 32(12):1093-1107. DOI: 10.1080/0049825021000017911.
37.CrewsKR, GaedigkA, DunnenbergerHM, et al. Clinical pharmacogenetics implementation consortium guidelines for cytochrome P450 2D6 genotype and codeine therapy: 2014 update[J]. Clin Pharmacol Ther, 2014, 95(4):376-382. DOI: 10.1038/clpt.2013.254.
38.海峡两岸医药卫生交流协会全科医学分会. 姑息治疗与安宁疗护基本用药指南[J]. 中国全科医学, 2021, 24(14):1717-1734. DOI: 10.12114/j.issn.1007-9572.2021.00.418.
39.NguyenL, ThomasKL, Lucke-WoldBP, et al. Dextromethorphan: an update on its utility for neurological and neuropsychiatric disorders[J]. Pharmacol Ther, 2016, 159:1-22. DOI: 10.1016/j.pharmthera.2016.01.016.
40.荣右明, 吴世福, 田月洁, 等. 右美沙芬滥用现状及应对策略[J]. 中国药物依赖性杂志, 2020, 29(3):191-195, 208. DOI: 10.13936/j.cnki.cjdd1992.2020.03.005.
41.DicpinigaitisPV, MoriceAH, BirringSS, et al. Antitussive drugs--past, present, and future[J]. Pharmacol Rev, 2014, 66(2):468-512. DOI: 10.1124/pr.111.005116.
42.陈爱欢, 陈慧中, 陈志敏, 等. 儿童呼吸安全用药专家共识:感冒和退热用药[J]. 中国实用儿科杂志, 2009, 24(6):442-446.
43.FindlayJW. Pholcodine[J]. J Clin Pharm Ther, 1988, 13(1):5-17. DOI: 10.1111/j.1365-2710.1988.tb00502.x.
44.马薇, 李晶. 肺癌患者合并顽固性咳嗽的治疗进展[J]. 医学综述, 2021, 27(2):308-312. DOI: 10.3969/j.issn.1006-2084.2021.02.018.
45.RidaPC, LiVeccheD, OgdenA, et al. The noscapine chronicle: a pharmaco-historic biography of the opiate alkaloid family and its clinical applications[J]. Med Res Rev, 2015, 35(5):1072-1096. DOI: 10.1002/med.21357.
46.TianX, LiuM, HuangX, et al. Noscapine induces apoptosis in human colon cancer cells by regulating mitochondrial damage and warburg effect via PTEN/PI3K/mTOR signaling pathway[J]. Onco Targets Ther, 2020, 13:5419-5428. DOI: 10.2147/OTT.S232137.
47.RichardsL, LutzA, ChalmersDK, et al. Production of metabolites of the anti-cancer drug noscapine using a P450BM3 mutant library[J]. Biotechnol Rep (Amst), 2019, 24:e00372. DOI: 10.1016/j.btre.2019.e00372.
48.SchildmannEK, RémiC, BauseweinC. Levodropropizine in the management of cough associated with cancer or nonmalignant chronic disease--a systematic review[J]. J Pain Palliat Care Pharmacother, 2011, 25(3):209-218. DOI: 10.3109/15360288.2011.583979.
49.ZhangH, ZhangZ, HuangY, et al. Repurposing antitussive benproperine phosphate against pancreatic cancer depends on autophagy arrest[J]. Mol Oncol, 2021, 15(2):725-738. DOI: 10.1002/1878-0261.12854.
50.ChenS, MinL, LiY, et al. Anti-tussive activity of benproperine enantiomers on citric-acid-induced cough in conscious guinea-pigs[J]. J Pharm Pharmacol, 2004, 56(2):277-280. DOI: 10.1211/0022357022719.
51.De SutterAI, SaraswatA, van DrielML. Antihistamines for the common cold[J]. Cochrane Database Syst Rev, 2015, (11):CD009345. DOI: 10.1002/14651858.CD009345.pub2.
52.赫捷, 李霓, 陈万青, 等. 中国肺癌筛查与早诊早治指南(2021, 北京)[J]. 中国肿瘤, 2021, 30(2):81-111. DOI: 10.11735/j.issn.1004-0242.2021.02.A001.
53.HomsiJ, WalshD, NelsonKA. Important drugs for cough in advanced cancer[J]. Support Care Cancer, 2001, 9(8):565-574. DOI: 10.1007/s005200100252.
54.中华医学会呼吸病学分会. 雾化祛痰临床应用的中国专家共识[J]. 中华结核和呼吸杂志, 2021, 44(4):340-348. DOI: 10.3760/cma.j.cn112147-20200623-00742.
55.王凯文, 杨之泠, 刘玉, 等. 中医药治疗肺癌相关性咳嗽研究进展[J]. 新中医, 2020, 52(14):10-13. DOI:10.13457/j.cnki.jncm.2020.14.003.
56.中国临床肿瘤学会血管靶向治疗专家委员会, 中国临床肿瘤学会非小细胞肺癌专家委员会, 中国临床肿瘤学会非小细胞肺癌抗血管生成药物治疗专家组. 晚期非小细胞肺癌抗血管生成药物治疗中国专家共识(2020版)[J]. 中华医学杂志, 2020, 100(46):3659-3673. DOI: 10.3760/cma.j.cn112137-20200918-02668.